
|
|
|||||
|
||||||
48个境外已上市临床急需新药名单征求意见摘要:
医药网8月9日讯 按照6月20日国务院常务会要求,根据《中华人民共和国药品管理法》和中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字﹝2017﹞42号)精神,为加快境外已上市临床急需新药进入我国,国家药品监督管理局、国家卫生与健康委员会组织有关专家,对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride 等48个境外已上市临床急需新药名单。该名单重点考虑近年来美国、欧盟或日本批准上市我国尚未上市的用于罕见病治疗的新药,以及用于防治严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药。
纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。即日起,上述48个药品申请人即可按《药物研发与技术审评沟通交流管理办法》(试行)的要求,向CDE提出Ⅰ类会议申请,对申报相关问题进行沟通。
8月8日,CDE将境外已上市临床急需新药名单和申报资料要求向社会各界征求意见,时间截止2018年8月18日。
境外已上市临床急需新药名单
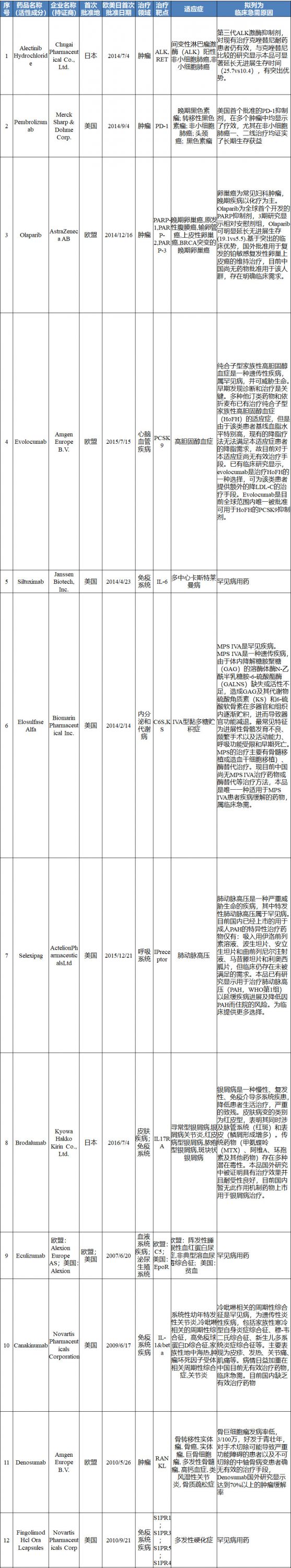 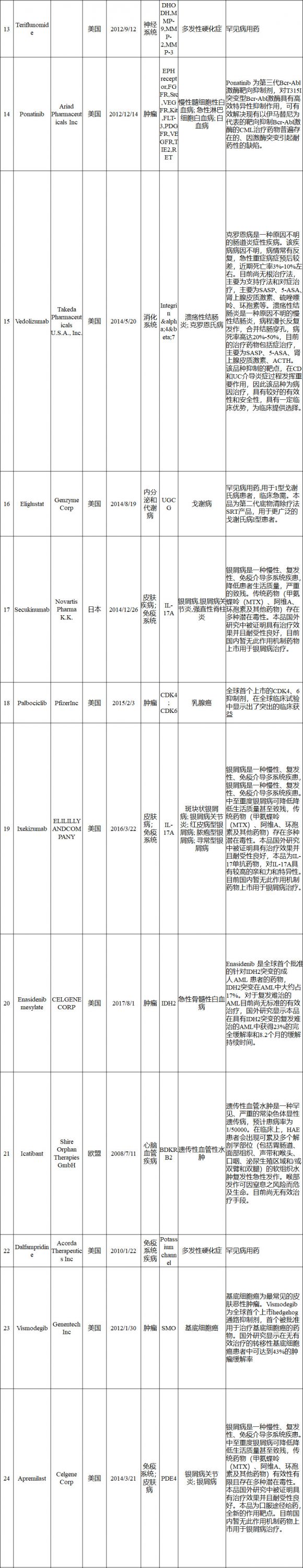 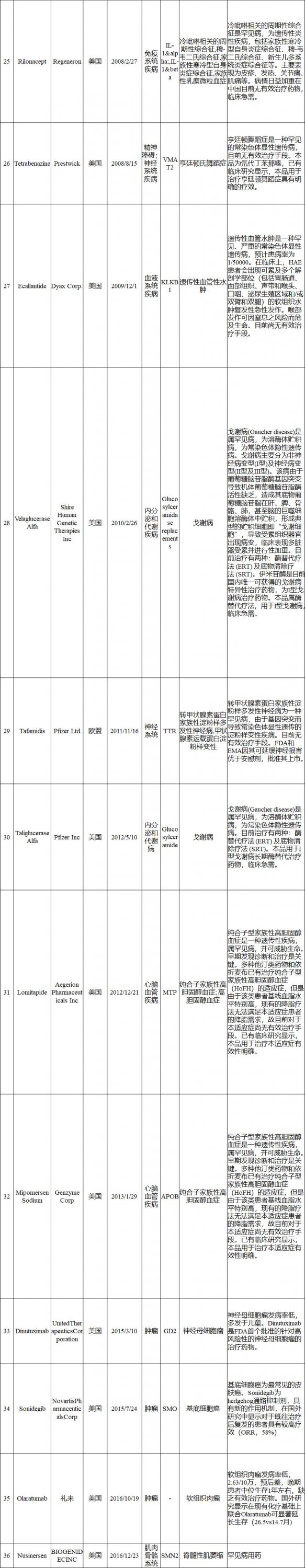 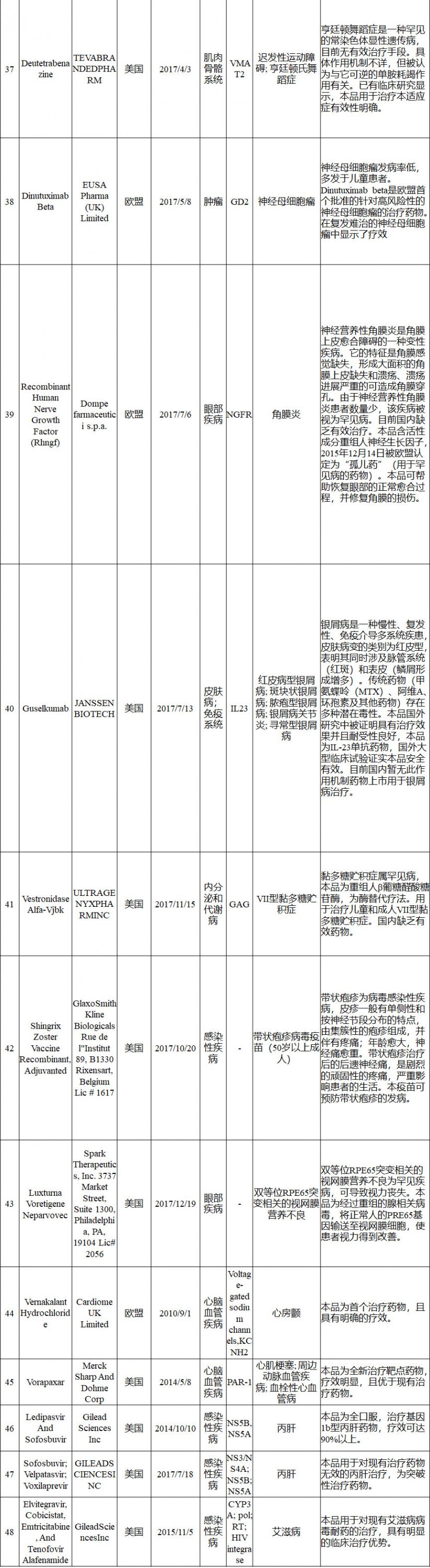 申报资料要求
境外已上市临床急需新药注册申请申报资料具体要求如下:
1.证明性文件
提供美国、欧盟和日本药品监管机构批准上市的证明性文件;提供该药品已在日本、香港、澳门、台湾等地区之一上市的证明文件,以及近五年内出口至该地区的药品数量及相关证明文件。
2.人用药品通用技术文档(CTD)要求
申请人应严格按照ICH CTD格式要求递交申报资料。申报资料应与报送至发达国家监管机构的内容基本相同,同时应提交上市后积累的研究数据。其中,CTD文件中M1模块、M2模块以及M3-M5模块关键研究报告的摘要部分,应为中文版,并附原文备查阅。提供的药品说明书,内容与原上市国审核发布说明书内容相同,格式采用原国家食品药品监督管理局《药品说明书和标签管理规定》(局令第24号)要求。
3.种族敏感性分析报告
申请人应参照ICH相关指导原则,对中国和/或亚裔人群与欧美人群疗效和安全性进行一致性分析。
4.上市后研究和上市后风险控制计划
申请人应根据总体有效性和安全性评价,以及种族敏感性分析情况,作出是否要开展上市后临床试验和制定上市后风险控制计划科学判断,提供必要的上市后研究计划和具体临床试验方案,以及上市后风险控制计划。
5.申报资料一致性声明
申请人应声明在中国申请进口的申报资料,应为申请上市时向国外监管机构报送的所有资料,以及上市后完成的相关研究资料。
|
|
Copyright ©2015 王中王中特
粤ICP备15022662号(粤)
-技术支持:信息管理部|联系我们
|