
|
|
|||||
|
||||||
1类化药申报数包揽前三 长三角医药产业优势分析摘要:
医药网8月22日讯 产业集聚是指在一个适当大的区域范围内,生产某种产品的若干个不同类企业,以及为这些企业配套的上下游企业及相关服务业高度密集地聚集在一起。在一定范围内,生产相同、相似产品的企业,或生产上下游产品的企业,在外在规模经济的驱动力下,为提高生产效率、降低交易和信息成本、增强企业竞争力,必然会逐步把本企业转移至相关产品的集聚区发展。美国旧金山湾区聚集了全美近24%的生物医药企业,对美国生物医药产业的发展起到巨大的支撑和引领作用,就是一个非常典型的案例。
笔者对纳入优先审评审批产品、1类新药申报以及通过一致性评价产品的区域归属情况进行细致分析,寻找我国医药产业的集聚特征。
优先审评:长三角集约化优势明显
对纳入优先审评审批的产品数量和企业数量进行分析,可从侧面反映出区域或药企的研发水平和活跃度。
从纳入优先审评的产品受理号数来看,江浙沪已经占到43%。相对地,广东排名第三,受理号数不及排名第一的江苏的一半。北京排名第四,受理号数不及江苏的三分之一。排名第五的四川和北京差距非常小。
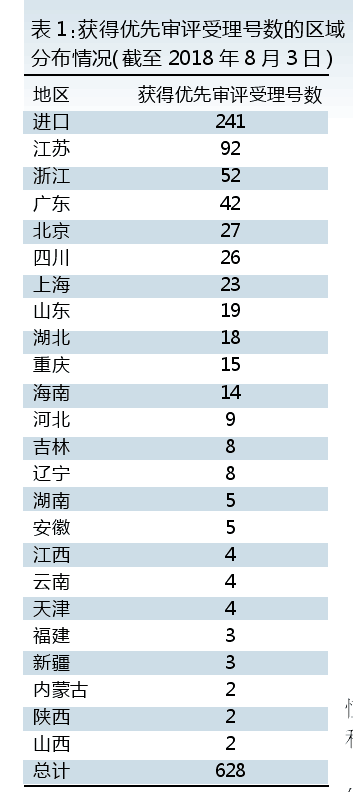 各省拥有纳入优先审评产品的企业数,可以透视出区域创新药企的活跃度。江苏创新药企活跃度排第一,受理号纳入优先审评审批的企业近20家。其中江苏恒瑞(含江苏盛迪)以23个受理号数排名第一,一家企业的受理号数就已接近北京市的受理号数。排名第二的是正大天晴,受理号数20个。排名第三是江苏豪森(含连云港宏创),受理号数13个。
浙江具纳入优先审评审批受理号产品的企业有12家。华海一家独大,受理号数30个排名第一,也是国内企业受理号数最多的企业。排名第二的是海正药业,包含海正宣泰、瀚晖制药(原海正辉瑞),受理号数为6个。
广东则以广东东阳光药业纳入优先审评审批的受理号数最多,为18个。排名第二的是佛山德芮可制药,共8个受理号数。广东具纳入优先审评审批受理号产品的企业近10家。作为省会城市的广州,并无一家企业纳入优先审评审批受理号数能排到全省前三。
北京拥有纳入优先审评审批受理号产品的企业有16家,排名第一的是北京凯因,受理号数仅为4个。
四川具纳入优先审评审批受理号产品的企业11家。成都汇宇以7个受理号数排名第一,排名第二的是4个受理号的四川国为。
整体而言,长三角区域药品研发生产集约化已经形成。
1类新药申报:上海和江苏生物制品布局领先
从2018年1类新药申报也可以从侧面反映各地对1类创新药研发的活跃度。其中,江沪浙承包了前三,北京排第四,广州排第五。
从产品类别来看,化药前三的省(市)分别为江苏、浙江和上海。治疗用生物制品前三的省(市)则是上海、江苏和北京。
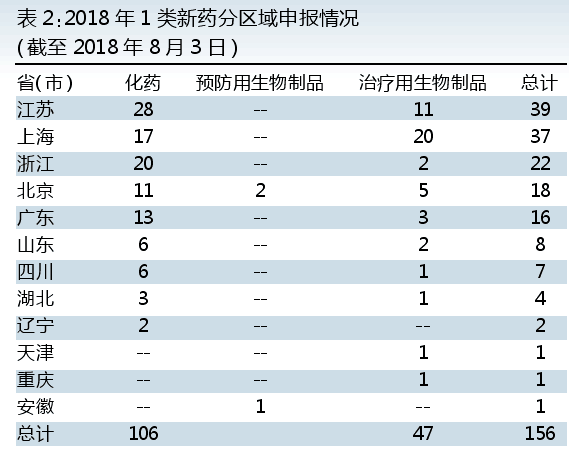 江苏恒瑞(含江苏盛迪)依然是江苏申报产品数最多的企业,申报了注射用SHR-1209、注射用卡瑞利珠单抗、注射用甲苯磺酸瑞马唑仑三个制剂产品。上海恒瑞还申报了SHR-1603注射液和SHR-1701注射液。
信达和江苏恩华并列第二。信达2018年上半年申报了注射用重组全人源抗肿瘤坏死因子受体超家族成员4OX40单抗和信迪利单抗注射液,信迪利单抗注射液属再次申报。江苏恩华申报了D20140305-1盐酸盐片和丁二酸齐洛那平片。
浙江则是海正药业参与的新药申报最多,参与了注射用重组抗人表皮生长因子受体人源化单抗偶联海兔毒素衍生物DUO5和重组抗PD-L1全人源单抗注射液2个产品。
上海则以上海优卡迪排名首位。上海优卡迪申报了白介素6分泌功能敲减的靶向CD19自体基因编辑T细胞注射液、程序死亡受体1敲减的靶向CD19嵌合抗原受体工程化T细胞注射液和程序死亡受体1敲减的靶向CD269嵌合抗原受体工程化T细胞注射液3个产品。基石药业、上海科济、上海恒润达生和益方生物并列第二,分别都申报了2个产品。基石药业申报了CS1003注射液和CS3006片,都是肿瘤治疗领域。上海科济2018年上半年申报了CT032人源化抗CD19自体CAR T细胞注射液和CT053全人抗BCMA自体CAR T细胞注射液。上海恒润达生申报了抗人BCMA T细胞注射液和抗人CD19T细胞注射液。益方生物申报了D-0502片和D-0751胶囊。由此可见,上海CAR T领域的申报在2018年上半年呈现出多家企业迸发的状态。
北京基本上是每家企业申报1个产品。广东也类似,广东众生申报2个产品排名第一,分别是ZSP1241片和ZSP1273片,其余都是1家企业申报1个产品。
综上所述,江苏和上海对于生物制品的布局已走在全国前列。
通过一致性评价:浙江依靠华海全国第一
通过仿制药质量和疗效一致性评价的情况,可以反映出各地药品企业对现有化学药生产批文的投入情况。截至2018年8月3日,浙江以20个受理号数排名第一,江苏排第二位,四川和广东并列第三。
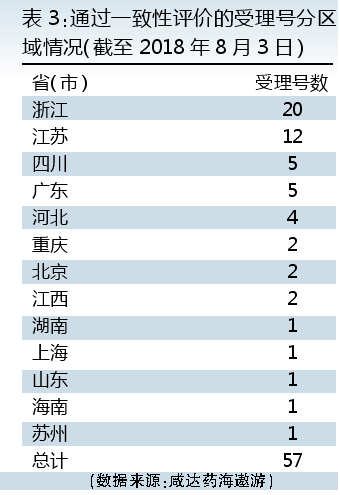 无论是浙江还是全国范围,浙江华海都是通过仿制药质量和疗效一致性评价产品和受理号数最多的企业,共通过厄贝沙坦片、厄贝沙坦氢氯噻嗪片、福辛普利钠片、赖诺普利片、利培酮片、氯沙坦钾片、奈韦拉平片和盐酸帕罗西汀片8个产品,大多数都是第一批通过仿制药质量和疗效一致性评价名单的产品。
海正药业(含原海正辉瑞)和浙江京新各以2个产品并列第二。海正药业(含原海正辉瑞)通过一致性评价的产品是厄贝沙坦片和瑞舒伐他汀钙片,浙江京新则是瑞舒伐他汀钙片和左乙拉西坦片通过一致性评价。
江苏正大天晴(含南京正大天晴)和扬子江药业(含江苏制药、上海海尼)并列江苏省第一,正大天晴通过一致性评价的产品有厄贝沙坦氢氯噻嗪片、瑞舒伐他汀钙片和恩替卡韦分散片三个产品。扬子江药业(含江苏制药、上海海尼)的苯磺酸氨氯地平片、蒙脱石散和马来酸依那普利片通过一致性评价。
四川省仅成都倍特有2个产品通过一致性评价,分别是富马酸替诺福韦二吡呋酯片和头孢呋辛酯片。
广东省共有3个企业各有1个产品通过一致性评价,广州最大的国企广药集团暂无产品通过一致性评价。
结语<<<
从目前数据来看,江沪浙已经逐步形成集约化医药研发创新产业优势领域。
北京与天津、河北、山东的环渤海暂未形成集约化。广东省目前医药产业主要分散在东莞、佛山、珠海和深圳,珠三角暂未形成集约化紧密合作的态势。四川则更多的集中在成都,成都和重庆之间的联盟暂未看到。
短期来看,对于江沪浙在医药研发创新的优势,其它地区短时间内难以赶超。
|
|
Copyright ©2015 王中王中特
粤ICP备15022662号(粤)
-技术支持:信息管理部|联系我们
|